User:Carlos Vázquez García/TFG/Parte5
From Proteopedia
6.2.6. Nuevos ligandos
El estudio de la proteína K-RAS está en constante desarrollo. Por ello en este trabajo se incluirán algunos ejemplos de nuevos ligandos descubiertos.
6.2.6.1. 4-bromobenzotiol
|
En este caso el ligando es una molécula con un marcado carácter apolar, pues el anillo de benceno sin sustituyentes presenta un momento dipolar de 0 D. Por lo tanto es lógico pensar que el ambiente en el que se puede situar de forma estable la molécula es un ambiente hidrofóbico, proporcionado parcialmente en este caso por leucina 56. Así mismo se puede apreciar cómo el grupo tiol (SH) establece interacciones con el azufre de cisteína, favoreciendo el acomodamiento. Este lugar de unión puede ser perfectamente un centro alostérico de la proteína [16].
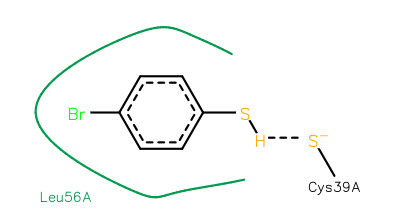
Figura 8. Interacciones del 4-bromobenzotiol en un nuevo bolsillo de K-RAS [16].Vista ampliada
6.2.6.2. Benzimidina
|
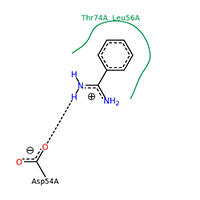
Figura 9. Interacciones de la benzimidina en un nuevo bolsillo de K-RAS [17]. Vista ampliada
Otro ligando no habitual es la benzimidina. Este ligando fue usado en un estudio relativamente reciente [7]. En dicho estudio los autores explican cómo esta molécula es capaz de unirse a un bolsillo de la proteína distinto al habitual, ocasionando la inhibición de la actividad de intercambio GTP/GDP vía proteínas SOS. En palabras sencillas, esta molécula provoca un cambio conformacional que inactiva a la proteína, y esto impide que tenga lugar la proliferación celular; es por tanto una posible nueva estrategia en el tratamiento de enfermedades neoplásicas. Si acudimos a la tabla 3 donde se especifican los principales aminoácidos que forman el bolsillo se observa cómo efectivamente treonina 74 y leucina 56 no aparecen, por tanto esto podría ser otro centro alostérico. Como en el caso anterior, se puede observar la importancia del ambiente hidrofóbico para el anillo de benceno proporcionado por estos dos aminoácidos.
Llama la atención el puente de hidrógeno establecido entre el grupo carboxilo (desprotonado a pH fisiológico) y el grupo amino. El donador del puente de hidrógeno sería el grupo amino, y el aceptor sería el grupo carboxilo desprotonado del aspártico.
6.2.6.3. N-{1-[N-(2,4-diclorofenil)glicil]piperidin-4-il}etinilsulfonamida
|
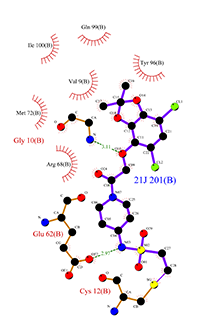
Figura 10. Interacciones del N-{1-[N-(2,4-diclorofenil)glicil]piperidin-4-il}etinilsulfonamida' en un nuevo bolsillo de K-RAS [18]. Vista ampliada
Este ligando es otra muestra de la relevancia de K-RAS en la clínica oncológica. Una de las vías más eficaces para inhabilitar o cambiar la conformación de una proteína es la unión a la misma de forma covalente. En la actualidad algunos fármacos consiguen este tipo de inactivación, como Omeprazol, que es capaz de formar puentes disulfuro entre el azufre de la bomba de protones (ATPasa H+/K+) y el azufre de la molécula medicamentosa. En este particular caso el ejemplo es parecido, pues observamos cómo el azufre de la cisteína establece una interacción muy fuerte con el carbono de la etanosulfonamida. Lo importante a reseñar sobre este ligando es que es selectivo, es decir, que solamente puede interaccionar con la cisteína que aparece en la proteína mutada, ausente en la nativa o inalterada. Esto representa un resultado muy prometedor porque significaría la simbiosis entre alta eficacia y selectividad. Del mismo modo que en ligandos anteriores, la presencia de anillos bencénicos se ve favorecida por un entorno hidrofóbico otorgado por los aminoácidos que se rodean de líneas rojas.
