2v65 (Italian)
From Proteopedia
| |||||||
| 2v65, resolution 2.35Å () | |||||||
|---|---|---|---|---|---|---|---|
| Activity: | L-lactate dehydrogenase, with EC number 1.1.1.27 | ||||||
| Related: | 2v6b | ||||||
| |||||||
| |||||||
| Resources: | FirstGlance, OCA, RCSB, PDBsum | ||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||
APO LDH DAL PSICROFILE C. GUNNARI
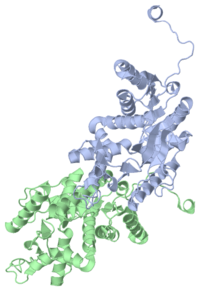
L'enzima lactate dehydrogenase (LDH) catalizza la conversione del pyruvate al lactate con ossidazione concomitante di NADH durante l'ultimo passo nella glicolisi anaerobica. In questi studi, noi presentiamo un'analisi biochimica e strutturale comparata di varie LDH adatte funzionalmente a una grande serie di temperature. Gli enzimi erano quelle di Champsocephalus gunnari (un pesce dell'Antartico), di Deinococcus radiodurans (un batterio mesofilo) e di Thermus thermophilus (un batterio ipertermofilo). I parametri di attivazione termodinamica di queste LDH indicano che l'adattamento alla temperatura da caldo alle condizioni fredde erano dovuti ad un calo nell'entalpia di attivazione ed ad un aumento nell'entropia di attivazione. Le strutture cristalline di queste LDH sono stato risolte. Paragoni per paia, al livello strutturale, tra la LDH ipertermofila contro la LDH mesofila, e la LDH mesofila contro la LDH psicrofila, hanno rivelato che l'adattamento alla temperatura è dovuto ad alcune sostituzioni di amino acidi che sono localizzate in regioni critiche dell'enzima. Queste sostituzioni, ciascuna che ha effetti che si accumulano, gioccano un ruolo nella stabilità conformazionale o nella flessibilità locale, o nell'ambo. Andando dalle LDH adattate al caldo a quelle adattate al freddo, le varie sostituzioni hanno ridotto il numero di paia di ioni, ridotto la taglia di reti ioniche, creato interazioni sfavorevoli che implicano residui caricati, e indotto forte disordine locale. L'analisi delle LDH adattate a temperature estreme ha messo luce su come processi evolutivi spostano l'equilibrio sottile tra la stabilità generale e la flessibilità di un enzima.
Activity, stability and structural studies of lactate dehydrogenases adapted to extreme thermal environments., Coquelle N, Fioravanti E, Weik M, Vellieux F, Madern D, J Mol Biol. 2007 Nov 23;374(2):547-62. Epub 2007 Sep 22. PMID:17936781
From MEDLINE®/PubMed®, a database of the U.S. National Library of Medicine.
Riassunto tradotto da MEDLINE®/PubMed®, una banca dati del U.S. National Library of Medicine.
A proposito di questa Struttura
2V65 è una struttura a 2 catene di sequenze di Champsocephalus gunnari. Dalle informazioni cristallografiche completi sono disponibili su OCA.
Riferimento
- Coquelle N, Fioravanti E, Weik M, Vellieux F, Madern D. Activity, stability and structural studies of lactate dehydrogenases adapted to extreme thermal environments. J Mol Biol. 2007 Nov 23;374(2):547-62. Epub 2007 Sep 22. PMID:17936781 doi:http://dx.doi.org/10.1016/j.jmb.2007.09.049
Page seeded by OCA on Wed Feb 18 06:19:04 2009